
Глюкозодегідрогеназа (GDH)
опис
Глутаматдегідрогеназа (GDH) є мітохондріальним ферментом, який каталізує оборотне окислювальне дезамінування глутамату в a-кетоглутарат і служить ключовою ланкою між анаболічним і катаболічним шляхами.У ссавців ГДГ піддається алостеричній регуляції та має високу активність у печінці, нирках, мозку та підшлунковій залозі.Активність ГДГ у сироватці може бути використана для диференціації між захворюваннями печінки, спричиненими запаленням печінки, які не виявляють підвищеної активності ГДГ у сироватці, та захворюваннями, що призводять до некрозу гепатоцитів, що призводить до підвищення рівня ГДГ у сироватці.
Активність ГДГ визначається за допомогою аналізу поєднаних ферментів, у якому глутамат споживається ГДГ, утворюючи НАДН, який реагує із зондом, утворюючи колориметричний (450 нм) продукт, пропорційний присутній активності ГДГ.Одна одиниця GDH - це кількість ферменту, який генерує 1,0 ммоль NADH за хвилину при рН 7,6 і 37 °C.
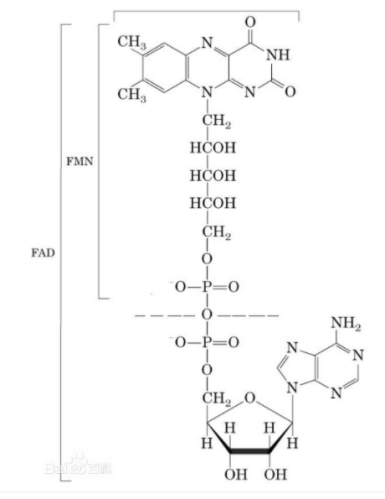
Хімічна структура
Механізм реакції
D-глюкоза + акцептор → D-глюконо-1,5-лактон + відновлений акцептор
Специфікація
| Тестові елементи | Технічні характеристики |
| опис | Білий аморфний порошок, ліофілізований |
| діяльність | ≥160 ОД/мг |
| Чистота (SDS-PAGE) | ≥90% |
| Розчинність (10 мг порошку/мл) | ясно |
| Забруднюючі ферменти | |
| Глюкозодегідрогеназа (НАД) | ≤0,02% |
| Гексокіназа | ≤0,02% |
| А-Глюкозидаза | ≤0,02% |
Транспортування та зберігання
Транспорт: Пакети з льодом
Зберігання:Зберігати при -25~-15°C (довгостроково), 2-8°C (короткочасно)
Рекомендований повторний тестжиття: 18 місяців














